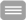PETN-induzierte antioxidative Eigenschaften in Endothelzellen als Ziel für die sekundäre Prävention endothelialer Dysfunktion in der Schwangerschaft
Diese Untersuchungen sollen die grundlagenwissenschaftliche Basis legen zu den klinischen Untersuchungen, die die protektive Wirkung von PETN bei Schwangeren mit erhöhtem Risiko für fetale Wachstumsrestriktion (fetal growth restriction FGR) zeigen. Damit ist dieses Projekt ein typisches Beispiel für translationale Forschung.
Nach heutigem Wissensstand kommt es bei der Präeklampsie aufgrund einer gestörten Differenzierung des Trophoblasten in der frühen Schwangerschaft zu vermehrter Freisetzung von das Endothel aktivierendem löslichen VEGF- Rezeptor-1 (sFlt-1) und Endoglin aus der Plazenta (Huppertz 2008, Roberts 2009). Gleichzeitig wird der endothelprotektive plazentare Wachstumsfaktor PlGF vermindert produziert. Es kommt zu einem Ungleichgewicht von endothelprotektiven und endothelaktivierenden Faktoren im Kreislauf der Mutter und damit zu einer generalisierten endothelialen Dysfunktion mit Gerinnungsaktvierung, Erhöhung der Permeabilität des Endothels und Blutdruckerhöhung (Asif Ahmed und Wenda Ramma 2011). Bei der FGR ist die Trophoblasteninvasion und in der Folge die adäquate Umwandlung der Spiralarterien in widerstandlose Gefäße unzureichend. Die Perfusion der Plazenta ist gestört. Auch bei der FGR kommt es zu einer eingeschränkten Funktion der Gefäße mit erhöhtem sFlt-1 und erniedrigtem PlGF im maternalen Kreislauf (Taylor 2003). Frauen, die während der Schwangerschaft eine PE oder eine FGR entwickeln, haben aufgrund einer gestörten endothelialen Funktion lebenslang ein erhöhtes Risiko für kardiovaskuläre Erkrankungen (Brown et al. 2013).
NO-Donoren bewirken eine Gefäßdilatation und somit ein Senkung des Blutdruckes. Bei Dauertherapie mit Nitraten wie Beispielsweise GTN kommt es zum Nachlassen der Wirkung, der sogenannten Nitrattoleranz. Unter Einnahme des NO-Donors Pentaerytrityltetranitrat (PETN) zeigt sich keine Nitratintoleranz, sondern eine langanhaltende Vasodilatation (Daiber et al. 2008). Darüber hinaus induziert PETN in Endothelzellen die Expression der antioxidativ wirkenden Hämoxygenase-1 (HO-1) (Pautz et al. 2009, Daiber et al. 2012). Der Wirkmechanismus der HO-1 beruht auf dem Abbau von Häm zu Kohlenmonoxid (CO), Eisen und Biliverdin, welches zu Bilirubin abgebaut wird (Sikorski et al. 2004). Dabei wirkt CO zusätzlich vasodilatatorisch und Bilirubin als Antioxidans. (George et al. 2014). Im Tiermodell konnte gezeigt werden, dass es durch die PETN induzierte Expression der HO-1 zu einer Abnahme der Bildung von Sauerstoffradikalen und zu einer Senkung des Blutdrucks ohne Entstehen von Nitrattoleranz kam (Schuhmacher et al. 2010, Wenzel et al. 2007). PETN verlangsamt darüber hinaus in der Folge der erhöhten Expression von HO-1 den Progress der Arteriosklerose (Polte et al. 2000, Oppermann et al. 2009). Bei Fehlen der HO-1 kommt es umgekehrt zu ausgedehnter endothelialer Dysfunktion mit Gerinnungsaktivierung, intravasaler Hämolyse und Endotheluntergang (Yachie et al. 1999).
Im Rahmen einer klinischen Studie an der Universitätsfrauenklinik Jena konnte gezeigt werden, dass die Behandlung mit PETN bei Hochrisikopatientinnen zu einer Reduktion des Risikos für FGR, perinatalem Tod, Frühgeburt und vorzeitige Plazentalösung führte. Zusätzlich zeigte sich ein deutlich milderer Verlauf der aufgetretenen PE, die später in der Schwangerschaft auftraten und seltener mit Frühgeburt und schwerer FGR assoziiert waren (Schleussner et al. 2014). Die Ursache für den günstigeren Verlauf der Erkrankung ist neben der vasodilatorischen am ehesten mit der endothelprotektiven Wirkung von PETN zu erklären. Dieser Zusammenhang soll in der vorliegenden Arbeit in vitro untersucht und weiter aufgeklärt werden.
Als zelluläres Modell zur Untersuchung der endothelialen Dysfunktion werden in der Zellkultur HUVEC Monolayer verwendet. Eine intakte Monolayerfunktion zeigt sich durch eine konstante Dichte mit konstanter elektrischer Resistenz in der Impedanzmessung im XCelligence®-System, einer kontinuierlichen Färbung für interendotheliale Adhäsionsmoleküle wie dem VE-Cadherin in der Immunzytologie, sowie Aktivierung von Überlebenssignalen durch VEGF. Diese Funktionen werden durch die Zugabe von endothelaktivierender Substanzen gestört. Die Dysfunktion des endothelialen Monolayer in der Zellkultur zeigt sich dann durch den Zusammenbruch der Barriere im XCelligence®-System, immunzytologisch in einem diskontinuierlichen Färbungsmuster von VE-Cadherin, in der Ausschüttung von endothelialen Aktivatoren, wie sFlt-1 in das Zellkulturmedium und Aktivierung von Signaltransduktionswegen, die eine gesteigerte Proliferation und Migration der Endothelzellen vermitteln. Dabei werden die Signale in den Endothelzellen hauptsächlich über den VEGF-Rezeptor 2 vermittelt, der im stabilen Endothelzellmonolayer mit VE-Cadherin an der Zellmembran im Komplex ist und über PI3K und AKT Survivalpathways in den Zellen aktiviert.
In dysfunktionellen Monolayern wird nach Aktivierung von VEGFR2 über PKC ERK1/2 aktiviert und Migration und Proliferation stimuliert (Cross 2003): Eine Aktivierung von VEGFR-2 mit Phosphorylierung des Rezeptors an PY99 führt dabei dann auch zur Ausschüttung von sFlt-1 (Cudmore 2007). Es ist gezeigt, dass HO-1 Induktion in Endothelzellen zu einer verringerten Ausschüttung von sFlt-1 führt (Cudmore 2007). In vivo wird die Expression von HO-1 durch verschiedene Effektoren in Endothelzellen ausgelöst. In der Folge wirkt es über die Anreicherung von Häm und CO intrazellulär antiapoptotisch, antiproliferativ und anti-inflammatorisch (Loboda, 2016).