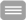AG Morales
Stellv. Laborleiterin,
AG-Leiterin: Extrazelluläre Vesikel und miRNA
Thematik
Unsere Forschung konzentriert sich auf drei sich überschneidende Bereiche:
Die feto-maternale Kommunikation, die durch extrazelluläre Vesikel und mikroRNAs vermittelt wird. Die mütterliche immunologische Anpassung und der Umbau des Gehirns und wie diese nach der Geburt fortbestehen. Und die Wirkung von Schadstoffen auf die Gesundheit der Mutter und die Schwangerschaft.
Wir führen Studien durch, um die Funktion von miRNAs aus Trophoblast-, Endothel- und Immunzellen zu charakterisieren. Unser Fokus liegt dabei in der Entdeckung von potentiellen miRNA Spezies, die nützliche Werkzeuge für die Diagnostik und die Behandlung von schwangerschaftsassoziierte Pathologien darstellen.
Wir arbeiten in Kollaboration mit Laboren und Forschungs-Teams in Europa und Amerika.
Mitglieder der Arbeitsgruppe

AG Morales

AG Morales

AG Morales


AG Morales

AG Morales

Offene Stellen
Promotionsstipendium
Die Else Kröner-Promotionskollegs Jena School for Ageing Medicine bietet ein monatliches Promotionsstipendium über 1000€ für 1 Jahr.
Wir suchen hochmotivierte Studierende,
- der Human- und Zahnmedizin ab dem fünften Fachsemester
- mit großem Interesse an einer medizinischen Promotion im Bereich der Altersmedizin
- die sich für zwei Semester vom Studium zur Arbeit am wissenschaftlichen Projekt beurlauben lassen
- die sich zur regelmäßigen Teilnahme am Ausbildungsprogramm der JSAM verpflichten
- die sich durch selbstständiges Arbeiten und ein hohes Maß an Eigeninitiative auszeichnen
zum Thema: Einfluss auf plazentare EVs auf mütterliche Gehirnzellen
Die meisten Frauen werden mindestens einmal im Leben schwanger. Unbekannt ist aber, wie sich dieser Prozess auf ihr Gehirn auswirkt und welche Veränderungen vorübergehend oder dauerhaft sind. Die physiologische Schwangerschaft wurde mit einem postpartalen Verjüngungseffekt des Gehirns der Mütter in Verbindung gebracht, aber auch mit einer lang- anhaltenden Abnahme der Hirngröße. Darüber hinaus stellt Präeklampsie, eine gefährliche Komplikation der Schwangerschaft, ein Risiko für die Alzheimer-Krankheit und neurologischen Komplikationen dar. Die Mechanismen der Kommunikation zwischen Plazenta und Gehirn sind unklar, und wir vermuten, dass die extrazellulären Vesikel (EVs) das fehlende Bindeglied sein könnten. In diesem Projekt wird ein Modell der Blut-Hirn-Schranke (BHS) in einem mikrofluidischen Biochip eingesetzt, um die Auswirkungen auf die Struktur der BHS und die Funktion der Nervenzellen zu untersuchen, die durch physiologische und pathologische Plazenta-EVs verursacht werden. Dieses Projekt kann dazu beitragen, die zerebrovaskulären Beeinträchtigungen der Präeklampsie und deren Auswirkungen auf die Gehirnalterung der Mutter zu verstehen.
Bitte kontaktieren Sie bei Interesse bis 15.01.2021
Dr. Diana Maria Morales Prieto, AG Morales
Masterarbeit
We investigate functions of microRNAs on trophoblast, endothelial and immune cells. The focus is on identification of potential miRNA species that may be useful tools for diagnostics and treatment of pregnancy-associated pathologies. We work in collaboration with laboratories and research teams in Europe and America.
What we offer:
- Modern research facilities in a university hospital
- Supervision of master thesis. As student there is a possibility to participate in activities such as workshops and congresses.
- Internship up to 16 months in our laboratory in Jena, Germany
- Structured research and supervision
What we look for:
- Highly motivated and qualified master students
- Students with interest in immunology and molecular biology willing to join our team
- Applicants must possess good English language skills
Please contact:
Dr. Diana Maria Morales Prieto, AG Morales
Alumni
o Hephzibah Winter, cand. M.Sc.
o Lazaro Pereira, Dr. med.
o Michael Schönleben, Dr.med.
o Ruby Gutierrez, Dr. med.
o Jose Martín Murrieta Coxca, PhD
o Daniel Fabig, cand. Dr. med.
o Ivan Dimitrov, cand. Dr. med.
o Yvonne Heimann, M.Sc.
Aktuelle Projekte:
DFG-Projekt 2021/2022
Proteomanalysen von plazentaren extrazellulären Vesikeln und Glykoproteinen auf der Oberfläche von deren Ziel-Immunzellen
Eine erfolgreiche Schwangerschaft hängt von einer komplizierten Kommunikation zwischen fetalen Trophoblastzellen und mütterlichen Immunzellen ab. Diese Kommunikation kann durch die Freisetzung extrazellulärer Vesikel (EVs) erfolgen, die u.a. Proteine und Nukleinsäuren aus der Ursprungszelle beinhalten. Der mikroRNA (miRNA)-Fracht der EVs wurde bisher große Aufmerksamkeit geschenkt, da sie das Potenzial hat, die Genexpression in den Empfängerzellen post-transkriptionell zu verändern.
Wir haben bereits früher gezeigt, dass Trophoblastzellen ein einzigartiges miRNA-Profil exprimieren, welches Spezies umfasst, die fast ausschließlich vom Plazentagewebe exprimiert werden. Diese miRNAs regulieren in vitro zelluläre Prozesse von Trophoblastzellen, wie Zellproliferation und -invasion, sowie ihre Fähigkeit, mit Endothelzellen zu interagieren. In einem zweiten Schritt untersuchten wir das miRNA-Profil des Plazentagewebes bei normalen und pathologischen Schwangerschaften, nämlich bei Präeklampsie (PE), intrauteriner Wachstumsrestriktion (IUGR) und Placenta-Accreta-Syndrom (PAS). Veränderte miRNA-Spezies wurden identifiziert und mit intrazellulären Signalwegen und zellulären Funktionen assoziiert. Danach wurden Zelllinien, die singuläre Immunzellpopulationen modellierten, mit von Trophoblasten sezernierten EVs behandelt, welche modifizierte Konzentrationen von plazentaren miRNAs enthielten. Wir konnten bestätigen, dass plazentare miRNAs, einschließlich derer, die in pathologischen Umgebungen dysreguliert sind, über EVs von Trophoblastzellen sezerniert werden und dass sie nach der Internalisierung durch Immunzellen deren Genexpression beeinflussen.
In vivo ist eine Anpassung der Immunzellpopulationen in der Decidua für die Etablierung einer Schwangerschaft notwendig, während hämatologische Veränderungen im peripheren Blut erforderlich sind, um eindringende Mikroorganismen zu erkennen und auf diese zu reagieren. Diese Immunantworten werden durch Glykoproteine auf der Oberfläche von Zellen vermittelt, deren Expression durch die Aufnahme von vesikulären Proteinen, die von den EVs transportiert werden, verändert werden könnte. Wir stellen die Hypothese auf, dass nach der Internalisierung das Proteom von aus der Plazenta stammenden EVs (PDEVs) die Funktion der Immunzellen durch die Modifikation der Glykoproteinexpression spezifisch geformt wird.
Um dies zu beweisen, sollen PDEVs durch ex vivo-Plazenta-Perfusion gewonnen werden und dann hinsichtlich Größe, Konzentration und Proteingehalt durch Proteomanalyse charakterisiert. Periphere mononukleäre Blutzellen (PMBCs) werden aus Vollblutproben isoliert und die PDEV-Aufnahme wird mittels Durchflusszytometrie und konfokaler Mikroskopie beurteilt. Schließlich wird das Proteom der Empfängerzellen unter besonderer Berücksichtigung der Glykoproteinidentifizierung analysiert, gefolgt von einer bioinformatischen Analyse zur Identifizierung veränderter Proteine und ihrer assoziierten Signalwege.
DFG-Projekt 2014-2021
Projektbeschreibung
Trophoblastzellen sind für die Implantation der Frucht in das mütterliche Gewebe und für den Umbau der mütterlichen Spiralarterien verantwortlich. Schwangerschaftspathologien wie Präeklampsie (PE) und intrauterine Wachstumsretardierung (IUGR) sind häufig mit nicht ausreichender Blutgefäßtransformation verbunden, während erhöhte Trophoblastinvasion in Placenta accreta (PA) beobachtet wird. Die Regulation zahlreicher Trophoblastfunktionen ist exakt kontrolliert durch intrazelluläre Moleküle, einschließlich microRNAs (miRNAs).Wir haben in früheren Arbeiten berichtet, dass die drei wichtigsten plazentaren miRNA-Cluster im Schwangerschaftsverlauf einer Kinetik unterliegt. Diese sind das Chromosom 14 MicroRNA Cluster (C14MC), C19MC und miR-371-3-Cluster. Im vorangegangenen Projekt wurde nachgewiesen, dass die Expression ausgewählter C14MC und C19MC miRNAs in gesunden und pathologischen Plazenten unterschiedlich ist, was auf ihr Potenzial als diagnostische Marker hindeutet. Anomale Expression von einigen dieser miRNAs scheint zu eingeschränkter Trophoblast-Proliferation, -Invasion und -Angiogenese führen, was die Assoziation dieser miRNAs mit der Entwicklung von Schwangerschaftspathologien unterstreicht.Wir und andere Autoren berichteten, dass Trophoblastzellen extrazelluläre Vesikel (EVs) in den mütterlichen Blutkreislauf sezernieren. Diese Vesikel enthalten plazentare miRNAs in ähnlichen Konzentrationen wie die Ursprungszellen. Die Funktion dieser Vesikel ist großenteils unklar, aber eine weitgehend akzeptierte Theorie sieht diese EVs als Vehikel einer Zell-zu-Zell-Kommunikation zwischen entfernten Zellen. Wir vermuten, dass Trophoblastzellen durch Freisetzung von EVs mit mütterlichen Immunzellen kommunizieren, insbesondere mit uterinen Natürlichen Killer (uNK) und T- Zellen. Des weiteren erwarten wir, dass trophoblastäre EVs in pathologischen Situationen veränderte miRNAs Konzentrationen enthalten, welche die Funktion derer Empfängerimmunzellen beeinflussen können. Ziel dieses Projektes ist, diese Hypothese zu prüfen. Hierzu sollen mütterliche Immunzellen mit trophoblastäten EVs, die physiologische oder pathologische miRNA Level enthalten, behandelt und deren zellulären Funktionen analysiert werden. Durch qPCR Arrays sollen weitere dysregulierte miRNAs in Plazentaproben von Patientinen mit PE, IUGR oder PA identifiziert werden. Danach werden trophoblastäre Zelllinien transfiziert, um EVs zu produzieren, deren miRNA Expression die von ausgewählten Pathologien simuliert. Die uNK und T-Zellen (primäre und Zelllinien) werden mit den isolierten EVs kultiviert und wichtige Zellfunktionen sowie die Sekretion von Cytokinen, Adhäsionsmolekülen und Chemokinrezeptoren analysiert. Schließlich soll eine in silico Analyse der zugeordneten Signalwege durchgeführt werden, um ein umfassendes Modell der Zell-zu-Zell-Kommunikation zwischen Trophoblast- und Immunzellen in physiologischen und pathologischen Situationen zu erstellen.
IZKF-Förderung 2019-2022
Die medizinische Fakultät fördert im Rahmen des Programmes "Förderung von Frauen in der Wissenschaft" die wissenschaftliche Karriere von Frauen am Uniklinikum Jena.
Frau Dr. rer. nat. Diana Morales erhielt für ihr seit 2019 gefördertes Projekt zum Thema: "Effects of physiological and pathological trophoblast-derived extracellular vesicles on the blood-brain-barrier and microglia" nun eine Verlängerung ab 01. Juni 2021 bis 30. Juni 2022.
Summary
During pregnancy, biochemical and structural changes in the brain adapt maternal physiology and behavior to ensure offspring survival. Remarkably, little is known about the molecular and cellular mechanisms that govern these processes and how they are influenced by pregnancy pathologies. Placental cells release extracellular vesicles (EVs) into the maternal blood as a mechanism of maternal-fetal communication. Although evidence shows that placental EVs mediate immune tolerance and cardiovascular adaptations in the maternal organism, their functions in the nervous system remains to be investigated. We hypothesize that placental EVs induce changes in the blood brain barrier (BBB) and modulate microglia cell responses. Moreover, these EVs may be the missing link between the placenta and neurologic manifestations of pre-eclampsia. A 3D BBB model in a microfluidic biochip will be employed to investigate BBB structure and properties under the effects of healthy and pre-eclamptic placental EVs. Additionally, mechanisms of placental EV uptake by microglia cells and their activation will be investigated. This proposal strengths a new research field in our group focused on understanding the biological mechanisms involved in the communication between placenta and brain in normal and pathological human pregnancies.
Promotionsprojekt JSAM 2020/21
Einfluss auf plazentare EVs auf mütterliche Gehirnzellen
Die meisten Frauen werden mindestens einmal im Leben schwanger. Unbekannt ist aber, wie sich dieser Prozess auf ihr Gehirn auswirkt und welche Veränderungen vorübergehend oder dauerhaft sind. Die physiologische Schwangerschaft wurde mit einem postpartalen Verjüngungseffekt des Gehirns der Mütter in Verbindung gebracht, aber auch mit einer lang- anhaltenden Abnahme der Hirngröße. Darüber hinaus stellt Präeklampsie, eine gefährliche Komplikation der Schwangerschaft, ein Risiko für die Alzheimer-Krankheit und neurologischen Komplikationen dar. Die Mechanismen der Kommunikation zwischen Plazenta und Gehirn sind unklar, und wir vermuten, dass die extrazellulären Vesikel (EVs) das fehlende Bindeglied sein könnten. In diesem Projekt wird ein Modell der Blut-Hirn-Schranke (BHS) in einem mikrofluidischen Biochip eingesetzt, um die Auswirkungen auf die Struktur der BHS und die Funktion der Nervenzellen zu untersuchen, die durch physiologische und pathologische Plazenta-EVs verursacht werden. Dieses Projekt kann dazu beitragen, die zerebrovaskulären Beeinträchtigungen der Präeklampsie und deren Auswirkungen auf die Gehirnalterung der Mutter zu verstehen.
Else Kröner-Promotionskollegs Jena School for Ageing Medicine