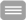Unsere aktuellen Studien zielen darauf ab, physiologische und pathophysiologische N-Ank-Proteine, eine neue Klasse leistungsfähiger Membranformer, molekular zu charakterisieren und damit der N-Ank-Protein-Superfamilie mechanistische und zellbiologische Funktionen zuzuweisen.
Forschungsprojekte
Charakterisierung von physiologischen und pathophysiologischen N-Ank Proteinen in Membranformung und zellulärer Morphogenese
Zellen von mehrzelligen Organismen müssen spezifische Morphologien annehmen. Die meisten Zellen mehrzelliger Organismen unterliegen während der Entwicklung ausgefeilten Formmodulationen. Neuronen weisen umfangreiche Veränderungen der Morphologie während der Bildung des neuronalen Netzwerks auf. Die molekularen Mechanismen, die zu Veränderungen der Membrantopologie führen, sind jedoch bei weitem nicht verstanden - vor allem, weil das Wissen über membranformende Proteine, die lokale Membrankrümmungen fördern können, noch begrenzt ist (Kessels & Qualmann 2021, Curr. Opin. Cell Biol.). Da Ankyrin repeats eine gekrümmte Struktur annehmen und mehrere Ankyrin repeat-Proteine zusätzlich vorhergesagte coiled coil-Domänen enthalten, haben wir uns mit der Hypothese befasst, dass diese Proteine bislang nicht erkannte, selbstassemblierende Membrankrümmungssensoren oder -induktoren sein könnten. In der Tat stellten wir fest, dass eine Unterfamilie von Ankyrin repeat-Proteinen, die wir als N-Ank-Proteine bezeichnen, eine Kombination aus einer amphipathischen α-Helix und krümmungserfassenden Ankyrin repeats verwendet, um Membranen zu formen (Wolf et al. 2019, Nat. Cell Biol.) Am Beispiel von Ankycorbin zeigten wir, dass diese beiden molekularen Merkmale des N-Ank-Moduls für die Gestaltung lokaler Membranprotrusionen in primären Hippocampus-Neuronen während der frühen Neuromorphogenese entscheidend sind (Wolf et al. 2019, Nat. Cell Biol.). Entscheidende molekulare Mechanismen sind hiermit i) Membraninsertion durch eine N-terminale amphipathische α-Helix, ii) Krümmungserfassung durch die gekrümmte Anordnung von Ankyrin repeats und iii) coiled-coil-vermittelte Selbstassoziation zur Bildung von Ankycorbin-angereicherten Nanodomänen in der Plasmamembran (Wolf et al. 2019, Nat. Cell Biol.). Unsere vergleichenden Charakterisierungen weiterer N-Ank-Proteine - von denen viele interessanterweise primatenspezifisch und größtenteils nicht charakterisiert zu sein scheinen - liefern klare und umfassende Beweise dafür, dass die Membranformung tatsächlich eine gemeinsame Fähigkeit der N-Ank-Module der neuen Protein-Superfamilie ist, die wir identifiziert haben (Wolf et al. 2019, Nat. Cell Biol.).


Neuronale Morphologie und Netzwerkbildung - Mechanismus, Kontrolle und zelluläre Funktion von Cobl-vermittelter Aktinnukleation
Die komplexe Architektur von neuronalen Netzwerken und die extreme Konnektivität von Zellen innerhalb dieser Netzwerke bildet die Grundlage für die Funktionen und Fähigkeiten der Gehirne höherer Organismen. Die räumliche und zeitliche Kontrolle von Aktinnukleation ist unabdingbar für die korrekte Ausbildung und Plastizität zellulärer Morphologie.
Die Bildung komplexer Aktinstrukturen ist für alle Eukaryonten lebensnotwendig, ist hierbei aber zwingend auf Faktoren, die den Zusammenbau der ersten Aktinmonomere (Nukleation) unterstützen, angewiesen. Mit Cobl haben wir einen neuen und sehr potenten Aktinnukleator identifiziert, der für korrekte Neuromorphogenese unabdingbar ist (Ahuja et al. 2007, Cell). Da exzessive, unkoordinierte Aktinfilamentbildung mit einer Vielzahl zellulärer Prozesse interferieren würde, die auf eine korrekte Organisation des Aktinzytoskeletts angewiesen sind, ist offensichtlich, dass die Cobl-vermittelte Aktinnukleation sorgfältig reguliert werden muss. Die Identifizierung und funktionelle Charakterisierung von Cobl Proteininteraktionen, die die subzelluläre Lokalisation und/oder die Aktivität dieser kraftvollen Nukleationsmaschinerie kontrollieren, erlaubt dabei die Aufdeckung molekularer Mechanismen einer Verknüpfung von Signalprozessen mit struktureller Organisation und Plastizität in Neuronen (Schwintzer et al. 2011, EMBO J.; Hou et al. 2015, PLoS Biol.; Hou et al. 2018, Dev. Cell). Unsere Identifizierung von Calmodulin, einem wichtigen Calciumsensor und Signalmolekül, als Ca2+-konzentrationsabhängiger Interaktionspartner für Cobl enthüllte einen molekularen Mechanismus, der die neuronale Calciumsignalisierung mit der aktingetriebenen neuronalen Arborisierung verbindet, die der Bildung des neuronalen Netzwerks zugrunde liegt (Hou et al. 2015, PLoS Biol.).
Die Identifizierung von Cobl als Ziel für die Arginin-Protein-Methyltransferase PRMT2 enthüllte, dass posttranslationale Modifikationen zusätzlich zur Ca2+/ Calmodulin-Signalübertragung den potenten Aktinnukleator Cobl steuern (Hou et al. 2018, Dev. Cell). Diese Studien erweitern daher entscheidend unser molekulares Verständnis von Aktinzytoskelettprozessen, die der Neuromorphogenese und der Bildung neuronaler Netzwerke zu Grunde liegen.


Loss-of-function Studien in Gesamtorganismen enthüllen wesentliche Rollen von F-BAR-Domänen-Proteinen in Membranformgebungsprozessen
Proteine der BAR-Superfamilie, die durch bogenförmige Membranbindungsschnittstellen gekennzeichnet sind, die unterschiedliche gekrümmte Membrantopologien erkennen und induzieren, haben sich als wichtige Komponenten in zellulären Membranformgebungsprozessen herauskristallisiert (Qualmann et al. 2011, EMBO J.; Kessels & Qualmann 2020, Biochem. Soc. Trans.; Kessels & Qualmann 2021, Curr. Opin. Cell Biol.). Unsere phänotypischen in vivo-Analysen von Knockout-Mäusen haben Evidenz für die physiologische Bedeutung des Membran-bindenden und Membrantopologie-modulierenden F-BAR Proteins Syndapin I für eine korrekte Gehirnfunktion erbracht. Syndapin I Knockout-Mäuse erleiden Krampfanfälle, ein Phänotyp, der mit einer übermäßigen Aktivität des Hippocampus-Netzwerks korreliert. Der Verlust von Syndapin I führt zu Defekten im präsynaptischen Membrantransportprozessen, Akkumulation endozytotischer Intermediate, Verlust der Kontrolle der Größe der synaptischen Vesikel, beeinträchtigter aktivitätsabhängiger Rückgewinnung der synaptischen Vesikel und fehlerhafter synaptischer Aktivität (Koch et al 2011, EMBO J.). Diese phänotypischen Analysen von Syndapin I KO-Mäusen unterstreichen somit die funktionelle Bedeutung von Syndapin I für die korrekte Bildung synaptischer Vesikel in Hippocampus- und Retina-Synapsen, für die korrekte Hippocampus-Netzwerkaktivität und für die korrekte Funktion des Gehirns von Säugetieren als solches.
Unsere Studien haben gezeigt, dass das F-BAR-Protein Syndapin I darüber hinaus ein entscheidender postsynaptischer Koordinator bei der Bildung exzitatorischer Synapsen ist (Schneider et al. 2014, J. Cell Biol.). Ein Syndapin I-Mangel führte zu einer signifikanten Verringerung der Synapsen und der dendritischen Dornfortsätze (spines). Ultrahochauflösende Bildgebung von spezifisch membranassoziiertem, endogenem Syndapin I an Membranen von gefriergebrochenen Neuronen zeigte, dass membrangebundenes Syndapin I bevorzugt in dendritischen spines auftrat und Cluster an distinkten postsynaptischen Membransubstrukturen bildete. Ein postsynaptischer Syndapin I-Mangel führte zu Defekten in der synaptischen Übertragung (Schneider et al. 2014, J. Cell Biol.). Mit Syndapin I angereicherte Membran-Nanodomänen scheinen daher wichtige räumliche Hinweise und Organisationsplattformen darzustellen, die dendritische Membranbereiche zu synaptischen Kompartimenten formen.

Schizophrenie ist mit kognitiven und Verhaltensstörungen assoziiert, von denen angenommen wird, dass sie Ungleichgewichte in Neurotransmissionssystemen widerspiegeln. Syndapin I KO-Mäuse entwickelten Schizophrenie-verwandte Verhaltensweisen wie Hyperaktivität, reduziertes Angstverhalten, reduzierte Reaktion auf soziale Neuheit und eine übertriebene Reaktion auf neuartige Objekte und zeigten Defekte bei der dendritischen Arborisierung im Kortex. Neuromorphogene Defizite wurden auch für eine Schizophrenie-assoziierte Syndapin I-Mutante in kultivierten Neuronen beobachtet und fielen mit einem Mangel an Syndapin I-vermittelter Membranrekrutierung von Zytoskelett-Effektoren zusammen (Koch et al. 2020, Cereb. Cortex). Syndapin I KO verursachte außerdem glutamaterge Hypofunktionen. Syndapin I regulierte sowohl die Verfügbarkeit von AMPA- als auch NMDA-Rezeptoren an Synapsen während der basalen synaptischen Aktivität und während der synaptischen Plastizität - besonders auffällig war das völlige Fehlen einer Langzeitpotenzierung (LTP) und Defekte bei der Langzeitdepression (LTD) bei Syndapin I KO-Mäusen. Diese synaptischen Plastizitätsdefekte fielen mit Veränderungen der postsynaptischen Aktindynamik sowie der Clusterbildung, der Mobilität und der Internalisierung von synaptischen AMPA-Rezeptoren zusammen (Koch et al. 2020, Cereb. Cortex). Zusammenfassend führte Syndapin I KO zu einem schizophrenieähnlichen Verhalten, und unsere Analysen deckten assoziierte molekulare und zelluläre Mechanismen auf.
Zusammenfassend haben unsere Untersuchungen auf verschiedenen Ebenen, die von Molekülen bis zu ganzen Organismen reichen, zu einem tieferen Verständnis der prä- und postsynaptischen Organisation und der Membrantransportprozesse sowie der Funktion von Syndapin I darin geführt und darüber hinaus wichtige neue Einblicke in die molekularen Mechanismen der Neurotransmission und synaptischen Plastizität einschließlich ihrer physiologischen Relevanz geliefert.
Die Rolle membranformender BAR-Domänenproteine bei der caveolären Membraninvagination: Von mechanistischen Einsichten zu pathophysiologischen Konsequenzen
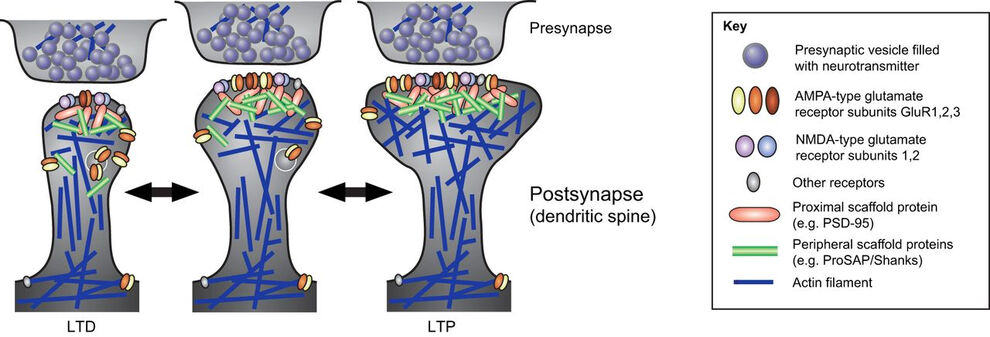
Die Bildung von caveolären Membraninvagination erfordert die koordinierte Aktion verschiedener Lipid-wechselwirkender und -formender Proteine. Die gegenseitige Abhängigkeit der Struktur von caveolären Invaginationen mit ihrer Funktion hat angesichts der Assoziation mehrerer menschlicher Krankheiten mit caveolärer Dysfunktion ein erhebliches wissenschaftliches Interesse hervorgerufen. Modellsysteme, denen die Kernkomponenten von Caveolae fehlen, ermöglichten keine explizite Zuordnung der beobachteten Funktionsstörungen zum Erfordernis der Caveolar-Invagination, da ihnen sowohl invaginierte Caveolen als auch Caveolin-Proteine fehlen (Kessels & Qualmann, 2020, Biochem. Soc. Trans.). Unsere Studien zeigten, dass der Funktionsverlust von Syndapin III ausschließlich zu einer Beeinträchtigung der caveolären Invagination führte, die nicht mit einer Reduktion von Caveolin oder Cavin an der Plasmamembran einherging, wodurch die Funktionen von caveolären Invaginationen als solche spezifisch enthüllt wurden (Seemann et al. 2017, Elife).

Muskelzellen von Syndapin III KO-Mäusen zeigten eine starke Reduktion von Caveolen, die an humane Caveolinopathien erinnert, und waren anfälliger für Membranschäden bei Änderungen der Membranspannungen. Dies steht in Übereinstimmung mit einer Funktion der Caveolen beim mechanischen Schutz, indem Membranreservoire bereitgestellt werden, die durch Caveolen-Abflachung verfügbar werden. Bei körperlicher Betätigung führte der Defekt der Invaginierung von Muskel-Caveolen unter Verwendung des membranformenden Syndapins III konsistenterweise zu pathologischen Defekten, die an die klinischen Symptome menschlicher Myopathien erinnern, was darauf hindeutet, dass die Fähigkeit von Muskel-Caveolen, auf mechanische Kräfte zu reagieren, ein wichtiger physiologischer Prozess ist (Seemann et al. 2017, Elife).
(für detaillierte Informationen siehe unsere Publikationen, Jahresberichte und unsere Projektbeschreibungen in englischer Sprache )
Weitere Forschungsprojekte am Institut siehe
AG Zellbiologie des Cytoskeletts - Labor Michael Kessels