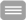Cadherine vermittelte Zell-Zellkontakte & Tight Junction-vermittelte Barrierefunktion
Zielsetzung
Aufklärung der Stuktur, Funktion und Regulation epithelialer Zell-Zellkontakte
Hintergrund
Die auf der Oberfläche von Zellen vorliegenden Zelladhäsionsmoleküle erlauben es den Zellen eines Organismus, spezifische Wechselwirkungen mit anderen Zellen oder der sie umgebenden extrazellulären Matrix einzugehen. Polarisierte epitheliale Zellen stehen über charakteristische Zell-Zellkontaktstrukturen (Tight Junction, Adherens Junction, Desmosomen, Gap Junctions) miteinander in Verbindung, die für die jeweilige Funktion von essentieller Bedeutung sind. Dabei vermitteln sie vielfältige Prozesse während der Entwicklung eines Organismus und sind somit wichtig für die Entstehung von Geweben und Organen. Auch im adulten Organismus sind diese Kontakte für eine Vielzahl von Prozessen von zentraler Bedeutung, z.B. bei der Aufrechterhaltung der Gewebestruktur, Zellwanderungsprozessen im Rahmen der Wundheilung und Immunantwort und bei der Regulation des Zelltods. Der Verlust der Zelladhäsion geht im Rahmen der Tumorprogression häufig mit gesteigerter Invasivität und Metastasierung einher. Unsere Arbeiten sollen zum Verständnis der molekularen Mechanismen beitragen, über die Zell- Zellkontakte an diesen Prozessen beteiligt sind.

Abb. 1: Schematische Darstellung typischer epithelialer Zell-Zellkontakte und ihres molekularen Aufbaus. Gap Junctions wurden aus Übersichtsgründen nicht berücksichtigt.
Cadherin-vermittelte Zell-Zellkontakte
Cadherine repräsentieren eine große Familie an Calcium-abhängigen Zelloberflächenglykoproteinen, die eine essentielle Rolle bei der Morphogenese und Differenzierung spielen. Sie stellen sowohl in den Adherens Junctions (AJ), als auch in den Desmosomen die zentralen Adhäsionsmoleküle dar und sind über charakteristische Adapterproteine mit dem Cytoskelett (Aktin: AJ bzw. Intermediärfilamente: Desmosomen) verbunden. Ein Verlust oder eine Verringerung der Cadherin-vermittelten Zell-Zelladhäsion wurde in verschiedenen klinischen Zusammenhängen beobachtet. So wird bei der Tumorgenese im Rahmen der epithelial-mesenchymalen Transition (EMT), die mit erhöhter Invasivität und Metastasierung einhergeht, die Transkription von E-Cadherin reprimiert. Bei Hauterkrankungen (z.B. Pemphigus vulgaris, Pemphigus foliaceus) beeinträchtigen Autoantikörper gegen Desmogleine die Adhäsion zwischen Keratinozyten und führen so zur typischen Blasenbildung. Neben den vielfältigen Morphogeneseprozessen erfordern Wundheilungsprozesse eine genaue Regulation von Cadherin-vermittelten Zell-Zellkontakten.
Struktur, Funktion und Regulation von Tight Junctions
Tight Junctions (TJs) sind die in polarisierten epithelialen und endothelialen Geweben am weitesten apikal gelegenen Zell-Zellkontaktstrukturen. Sie bilden eine Barriere, die die unkontrollierte Passage von Ionen, Soluten, Wasser, Toxinen oder Mikroorganismen durch den parazellulären Spalt verhindert. Neben dieser Barrierefunktion unterbinden die TJs die freie Diffusion von Transmembranproteinen von der apikalen zur basolateralen Seite der Zellen und tragen somit entscheidend zur Aufrechterhaltung der Polarität bei (Abb. 2). TJs bestehen aus hochmolekularen Proteinkomplexen, die ein perlschnurartiges Netzwerk aus TJ-Strängen ausbilden, über das die Membranen benachbarter Zellen in sehr engen Kontakt zueinander gebracht werden. Dieses Netzwerk ist aus den integralen Membranproteinen der TAMP (tight junction-associated MARVEL proteins)-Familie, zu denen Occludin, Tricellulin und MarvelD3 gezählt werden, sowie aus Mitgliedern der Claudin-Familie (Cldn1-27) aufgebaut. An die cytoplasmatischen Domänen dieser 4-Transmembrandomänenproteine binden verschiedene Adapter- und Regulatorproteine wie die Zonula occludens Proteine (ZO-1, -2, -3), die die TJs mit dem Aktincytoskelett verknüpfen. Daneben sind Transmembanproteine der Ig-Superfamilie (JAM, CAR, ESAM) an den TJs nachgewiesen worden.


Abb. 2: Aufbau und Struktur der Tight Junction. Schematische Darstellung des Aufbaus von TJs. Gefrierbruchelektronenmikroskopische Darstellung des TJ Strang-Netzwerks (Dr. Martin Westermann, EM-Zentrum, FSU Jena).
Strategie und Ergebnisse
Posttranslationale Modifikationen von TJ-Proteinen spielen eine zentrale Rolle bei der Regulation der TJ-Struktur und Funktion. Zudem zeigte sich in den letzten Jahren, dass einige der mit Adhäsionskomplexen assoziierte Proteine eine sogenannte NACos (Nuclear and adhesion complexes)-Funktion besitzen. Sie besitzen somit neben der Funktion in den Adhäsionskomplexen eine zweite Funktion im Zellkern, wo sie als Co-Faktoren an Prozessen der Transkriptionsregulation beteiligt sind. Damit besteht die Möglichkeit, dass Zell-Zellkontakten ausgehende Signale sehr schnell in den Zellkern weitergeleitet werden und zu Änderungen des Genexpressionsprogrammes führen können. Durch Identifizierung von an diesen Prozessen beteiligten posttranslationalen Modifikationen, Mutagenese der modifizierten Aminosäuren und Untersuchung der funktionellen Konsequenzen wollen wir ein besseres Verständnis über die Regulation von Zell-Zellkontakten bei der Tumorgenese, in der Sepsis und beim Altern erreichen.
Ausgewählte Referenzen
Janke S, Mittag S, Reiche J, Huber O. Apoptotic Fragmentation of Tricellulin. Int J Mol Sci. (2019) 10:3390
Wetzel F, Mittag S, Cano-Cortina M, Wagner T, Krämer OH, Niedenthal R, Gonzales-Mariscal L, Huber O. SUMOylation regulates the intracellular fate of ZO-2. Cell Mol Life Sci (2017) 74:373-392.
Jennek S, Mittag S, Reiche J, Westphal JK, Seelk S, Dörfel MJ, Pfirrmann T, Friedrich K, Schütz A, Heinemann U, Huber O. Tricellulin is a target of the ubiquitin ligase Itch. Ann NY Acad Sci (2017) 1397:157-168.
Huber O, Petersen I. 150th Anniversary Series: Desmosomes and the Hallmarks of cancer. Cell Commun Adhes (2015) 22:15-28
Dörfel MJ, Huber O. A phosphorylation hotspot within the occludin C-terminal domain. Ann N Y Acad Sci (2012) 1257: 38-44.
Dörfel MJ, Westphal JK, Bellmann C, Krug SM, Cording J, Mittag S, Tauber R, Fromm M, Blasig IE, Huber O. CK2-dependent phosphorylation of occludin regulates its interaction with ZO-proteins and tight junction integrity. Cell Commun Signal (2013) 11:40
Dörfel MJ, Huber O. Modulation of tight junction structure and function by kinases and phosphatases targeting occludin. J Biomed Biotechnol (2012) 2012:807356.
Westphal JK, Dörfel MJ, Krug SM, Cording JD, Piontek J, Blasig IE, Tauber R, Fromm M, Huber O. Tricellulin forms homomeric and heteromeric tight junctional complexes. Cell Mol Life Sci. (2010) 67<. 2057-2068
Tapia R, Huerta M, Islas S, Avila-Flores A, Lopez-Bayghen E, Weiske J, Huber O, Gonzalez-Mariscal L. Zona occludens-2 inhibits cyclin D1 expression and cell proliferation and exhibits changes in localization along the cell cycle. Mol Biol Cell (2009) 20:1102-17.
Krug SM, Amasheh S, Richter JF, Milatz S, Günzel D, Westphal JK, Huber O, Schulzke JD, Fromm M. Tricellulin forms a barrier to macromolecules in tricellular tight junctions without affecting ion permeability. Mol Biol Cell (2009) 20: 3713-3724.
Meyer zum Büschenfelde D, Hoschützky H, Tauber R, Huber O. Molecular mechanisms involved in the TFF3-peptide-mediated modulation of the E-cadherin/cathenin cell adhesion complex. Peptides (2004) 25:873-883.
Steinhusen U, Weiske J, Badock V, Tauber R, Bommert K, Huber O. Cleavage and shedding of E-cadherin after induction of apoptosis. J Biol Chem (2001) 276: 4972-4980
Weiske J, Schöneberg T, Schröder W, Hatzfeld M, Tauber R, Huber O. The fate of desmosomal proteins in apoptotic cells. J Biol Chem (2001) 276: 41175-41181.